Toxikologie und Sicherheitsbewertung
Toxikologische Studien, die zur Bestimmung des Toxizitätsprofils einer neuen Verbindung beitragen, sind eine Standardpraxis bei der Sicherheitsbewertung neuer Arzneimittel und Produkte. Invitrocue kann Standard durchführen in vitro und in vivo Toxikologiestudien und arbeiten mit Kunden zusammen, um neuartige Toxikologiestudien zu entwickeln.
In-vitro-Zytotoxizität
2D Modelle
- Menschliche primäre Keratinozytens
- Menschlicher primärer Fibroblasts
- Menschlicher primärer Hepatozyts
- Menschliches primäres Nasenepithel Zellen
- Humanes primäres Bronchialepithel Zellen
3D Modelle
- 3D Nasenepithelmodell
- 3D Hautmodell
- 3D Hepatozyten-Kupffer-Zelle Co-Kultur Modell
- 3D Hepatozyten-Kupffer-Zell-Stellat-Zelle Tri-Kultur Modell

Reaktives Acylglucuronid (RAG) induzierte idiosynkratische Toxizität
Viele Carbonsäure enthaltende Arzneimittel verursachen eine seltene, aber schwerwiegende idiosynkratische Arzneimitteltoxizität (IDT). Mehrere carboxylierte Medikamente wie ibufenac, Bromfenac, Zomepirac und Tienilsäure wurden aufgrund von IDT vom Markt genommen. Im Vergleich zum herkömmlichen LC-MS-Nachweisverfahren ist der RAG-Assay a einfacher, empfindlicher und skalierbarer Hochdurchsatz-Fluoreszenzassay, der den Nachweis von LAPPEN Formation in vitro.
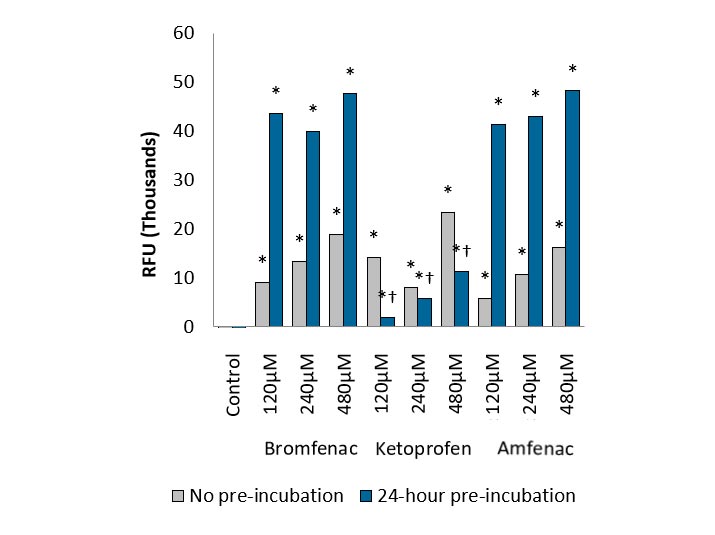
IDT reference compounds such as Bromfenac and amfenac showed significant resorufin response after 24h pre-incubation. Data was well-correlated to clinical IDT findings. (IVQ-2014)
Kardiotoxizitätstest (hERG)
Genotoxizitätstests
Die Bestimmung der potenziellen Genotoxizität einer Verbindung ist ein wichtiger Bestandteil einer vollständigen Sicherheitsbewertung fast aller neuen Produkte. Wir können die folgenden Genotoxizitätstests durchführen:
- Bakterieller Reverse Mutation Test (AMES; OECD TG 471)
- In-Vitro-Säugetierzell-Mikronukleus-Test (MNT; OECD TG 487)
In-vivo-Toxizität (GLP & Nicht-GLP)
Die Wirkstoffentdeckung ist ein langer Prozess, der präklinisch ist Sicherheit und Wirksamkeitsbewertung, klinische Studien und schließlich behördliche Zulassung, bevor Medikamente können Sein Markted. Mehr als 90% der Verbindungen werden vor Beginn der Phase-I-Studien aufgrund unerwarteter Toxizität, insbesondere Hepatotoxizität und kardiovaskulärer Toxizität, abgesetzt. Dies unterstreicht die Bedeutung eines Sicherheitsbewertungsmodells, mit dem die Ausfallraten bei der Arzneimittelentwicklung im Spätstadium minimiert werden können.
In vitro Toxizitätstests sind gut etabliert, um die Anforderungen des Hochdurchsatz-Screenings bei der Entwicklung neuer Arzneimittel zu erfüllen. Invitrocue bietet Toxizitätstests für Einzeldosen und wiederholte Dosen an, die den gesetzlichen Richtlinien für Ihre F & E-Anforderungen entsprechen.
- Dosisfindung (LD50) – Die mittlere letale Dosis (oder LD50) ist definiert als die Dosis eines Testartikels Das führens zu 50% Mortalität der Tiere in einer Gruppe. Im Allgemeinen verwenden Dosisfindungsstudien weniger Tieres die Dosis von vorherzusagen das Testartikel bei akuter Toxizität.
- Einzeldosis-Toxizitätstest – Akute Toxizität (14 -Tage; OECD TG 420) – Die sEinzeldosis Toxizität Die Studie ist der vorläufige Test zur Untersuchung der toxikokinetischen Eigenschaften und zur Bestimmung des NOAEL (No-Adverse Effect Level) und der maximalen Toleranzble Dosis (MTD) für die Untersuchungional Einreichung neuer Medikamente (IND).
- Toxizitätstest für wiederholte Dosen Abhängig von der therapeutischen Indikation, Dauer und dem Dosierungsschema kann die Toxizität weiter auf Studien zur subchronischen (28 -Tage) und chronischen (90 -Tage) Toxizität ausgedehnt werden. Das Hauptziel für die Toxizität bei wiederholter Gabe besteht darin, das toxikologische Profil von Testverbindungen nach wiederholten Arzneimittelverabreichungen zu charakterisieren. Diese Informationen sind zusammen mit der Wirksamkeit und der DMPK-Profilerstellung Teil der Sicherheitsbewertung, um die Genehmigung klinischer Studien und die anschließende Genehmigung für das Inverkehrbringen durch pharmazeutische Aufsichtsbehörden zu unterstützen.
- Subchronische Toxizität (28 -Tage; OCED TG 407)
- Chronische Toxizität (90 -Tage; OCED TG 408)