Evaluación de toxicología y seguridad
Los estudios de toxicología que ayudan a determinar el perfil de toxicidad de un nuevo compuesto son una práctica estándar en la evaluación de seguridad de nuevos medicamentos y productos. Invitrocue puede realizar estándares in vitro y en vivo estudios de toxicología y trabajo con clientes para desarrollar nuevos diseños de estudios de toxicología.
Citotoxicidad in vitro
2D Modelos
- Queratinocito primario humanos
- Fibroblasto primario humanos
- Hepatocito primario humanos
- Epitelio nasal primario humano Células
- Epitelio bronquial primario humano Células
3D Modelos
- 3 D Modelo epitelial nasal
- 3 Modelo de piel D
- 3 D Célula de Hepatocito-Kupffer Co-cultura Modelo
- 3 D Hepatocito-Célula de Kupffer-Célula estrellada Tri-cultura Modelo

Toxicidad idiosincrásica inducida por glucurónido de acilo reactivo (RAG)
Muchos fármacos que contienen ácido carboxílico provocan una toxicidad farmacológica idiosincrásica (IDT) rara pero grave. Varios fármacos carboxilados como ibufenac, bromfenac, zomepirac y ácido tienílico han sido retirados del mercado debido a IDT. En comparación con el método de detección LC-MS convencional, el ensayo RAG es un más simple, más sensible y escalable ensayo fluorescente de alto rendimiento que permite la detección de TRAPO formación in vitro.
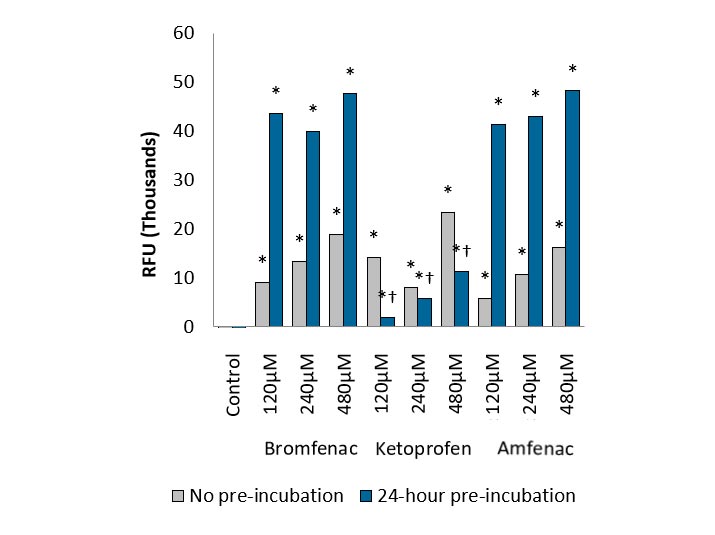
Compuestos de referencia IDT como Bromfenac y amfenac mostró una respuesta significativa de resorufina después 24 h de preincubación. Los datos estaban bien correlacionados con hallazgos clínicos de la TDI. (IVQ- 2014)
Ensayo de cardiotoxicidad (hERG)
Ensayos de genotoxicidad
La determinación de la genotoxicidad potencial de un compuesto es un componente importante de una evaluación de seguridad completa de casi todos los productos nuevos. Podemos realizar los siguientes ensayos de genotoxicidad:
- Prueba de mutación inversa bacteriana (AMES; OECD TG 471)
- Prueba in vitro de micronúcleos de células de mamífero (MNT; OECD TG 487)
Toxicidad in vivo (GLP y no GLP)
El descubrimiento de fármacos es un proceso largo que implica seguridad y evaluación de la eficacia, ensayos clínicos y finalmente aprobación regulatoria antes de que los medicamentos puedan ser mercadoed. Más del 90% de los compuestos se retiran antes de ingresar a los ensayos de Fase I debido a una toxicidad inesperada, especialmente hepatotoxicidad y toxicidad cardiovascular. Esto resalta la importancia de un modelo de evaluación de seguridad que pueda minimizar las tasas de fracaso en el desarrollo de fármacos en etapa tardía.
In vitro Las pruebas de toxicidad están bien establecidas para respaldar las necesidades de detección de alto rendimiento en el desarrollo de nuevos fármacos. Invitrocue ofrece pruebas de toxicidad de dosis única y dosis repetidas que cumplen con las pautas regulatorias para sus necesidades de I + D.
- Hallazgo de dosis (LD50): la dosis letal mediana (o LD50) se define como la dosis de un artículo de prueba ese dirigirs al 50% de mortalidad de los animales de un grupo. Generalmente, los estudios de búsqueda de dosis utilizan menos animaless para predecir la dosis de la artículo de prueba en toxicidad aguda.
- Prueba de toxicidad de dosis única: toxicidad aguda (14 días; OECD TG 420) – La sdosis única toxicidad El estudio es la prueba preliminar para investigar las propiedades toxicocinéticas y para determinar el nivel sin efectos adversos (NOAEL) y la tolera máxima.ble dosis (MTD) para investigarional presentación de nuevas drogas (IND).
- Prueba de toxicidad por dosis repetidas Dependiendo de la indicación terapéutica, la duración y el régimen de dosis, la toxicidad puede extenderse aún más a estudios de toxicidad subcrónica (28 días) y crónica (90 días). El principal objetivo de la toxicidad por dosis repetidas es caracterizar el perfil toxicológico de los compuestos de prueba después de administraciones repetidas de fármacos. Esta información forma parte de la evaluación de seguridad, junto con la eficacia y el perfil DMPK, para respaldar la aprobación de ensayos clínicos y la posterior autorización de comercialización por parte de los organismos reguladores farmacéuticos.
- Toxicidad subcrónica (28 días; OCED TG 407)
- Toxicidad crónica (90 días; OCED TG 408)