肝細胞
肝細胞是肝臟的主要功能細胞,負責大多數藥物的選擇性吸收、代謝及排出。
人原代肝細胞
人原代肝細胞是獲取臨床前數據的最佳模型,通常藥廠用於按FDA要求的藥物安全評估及DMPK分析。
在傳統平台 ( 2D夾心培養),原代肝細胞會隨時間流逝而失去活性及功能。應求的3D細胞三重培養模型顯示星狀細胞及Kupffer細胞能促進長久維持肝細胞功能,從而能更好地預測在人體內的結果。
相比傳統2D培養,3D肝細胞培養的優勢:
- 高通量及更符合成本效益(3D培養需要的原代肝細胞數量比2D培養少5倍)
- 能長久保持肝細胞功能
- 通過與其它肝細胞共培養促進肝CYP酶表達
- 藥物反應更貼近臨床結果

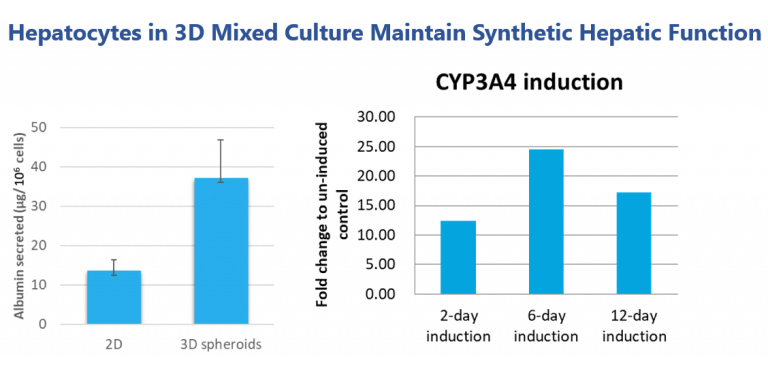
於我們的3D球體培養中,肝細胞顯示出更佳的表達功能,比如白蛋白分泌。3D肝細胞球狀體可維持肝細胞色素P450酶功能,可用作藥物誘導研究。
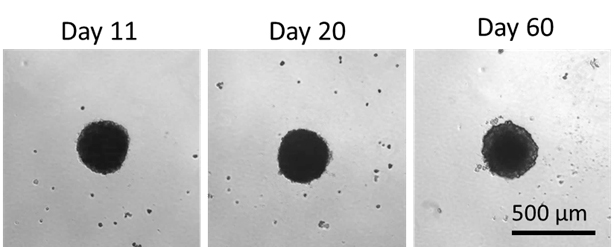
肝細胞活性可維持60日,顯示此為一個優質模型用作長期藥物毒性研究。
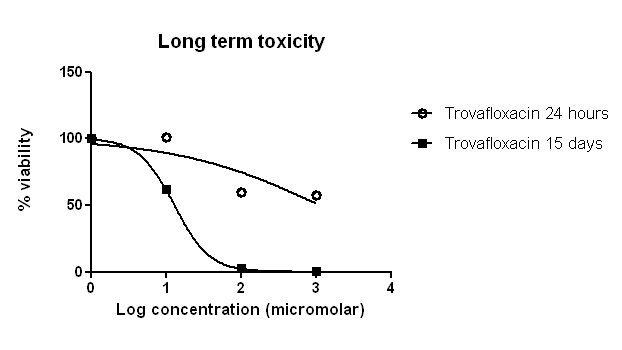
Trovafloxacin因有導致肝中毒的風險已被禁止於巿場中出售,最初它的毒性不能從傳統2D培養技術中辯識。但從我們的肝細胞及kupffer細胞共培養模型中,我們可以模擬人類肝臟的微環境及免疫誘導的肝毒性。
HBV病毒感染模型
慢性乙型肝炎感染在全球超過20億人中普遍存在,並導致50%的肝細胞癌病例(www.hepb.org)。更好 體外 小型動物模型可以改善對HBV的研究,並有助於開發針對這種疾病的新藥。
在應求,我們使用HepAD38細胞建立了二維HBV病毒感染模型,它是轉染了HBV基因組的改良HepG2細胞株。可使用tetracycline通過抑制前基因組(pregenomic)RNA來控制病毒的表達。如果從培養液中移除tetracycline,HBV轉錄水平的表達及病毒粒子就會顯著增加。基於HepAD38細胞株可產生大量旳HBV DNA及病毒表達很容易控制,所以HepAD38已成為一個高通量且價格相宜的新HBV藥物測試模型。

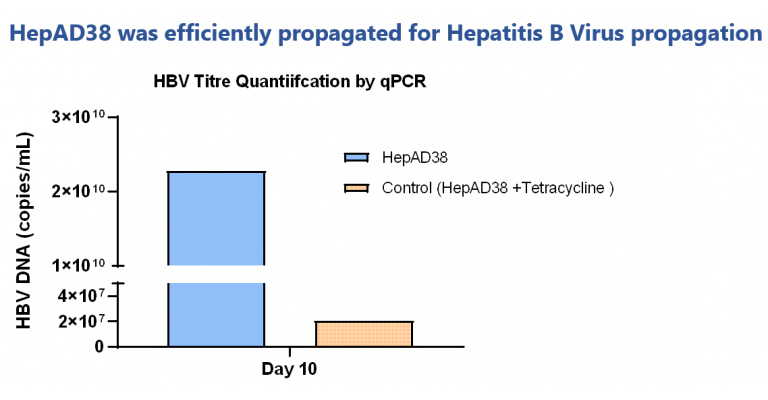
沉積的病毒定量顯示良好的滴度水平。Tetracycline對照顯示病毒滴度低。
參考: Ladner,Stephanie K.等人。 “人類乙型肝炎病毒(HBV)在穩定轉染的肝母細胞瘤細胞中的誘導型表達:一種篩選潛在的HBV複製抑製劑的新型系統。” 抗菌藥物和化學療法 41.8(1997):1715-1720。
肝細胞及iKCs細胞共培養
Kupffer cells (KC) 細胞佔人體内巨噬細胞的80-90%,它是先天肝臟免疫系統的最大細胞群,負責清除和吞噬功能,同時維持肝臟運作正常。
我們的iKCs及肝細胞共培養模型使用從同一iPSC供體來源的細胞,屬於供體匹配的共培養模型。對於研究肝臟及其相關疾病如NASH、肝炎及由免疫藥物導致的肝損傷(DILI),是非常有效的體外研究工具。

使用iKCs及肝細胞共培養模型檢測免疫誘導的肝損傷(DILI)
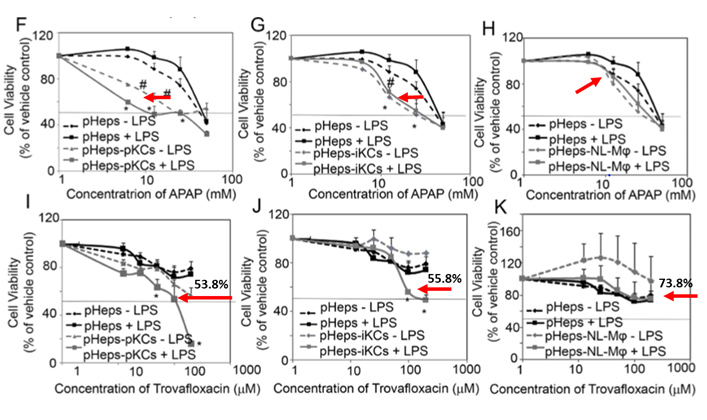
以上研究顯示參照藥物(acetaminophen (APAP) and Trovafloxacin) 在無免疫細胞的情況下呈現低毒性。當免疫細胞存在時,它們的肝毒性顯著增加(模擬臨床反應) ,此乃傳統模型無法預測的。
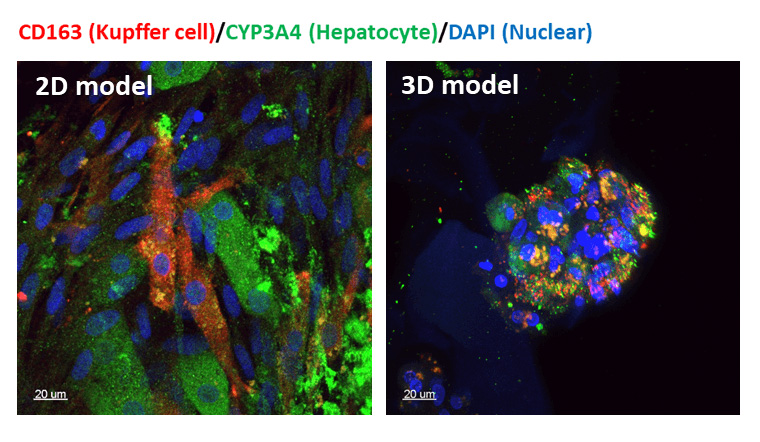
肝-Kupper細胞共培養的共聚焦圖像紅色的是Kupper細胞綠色的是肝細胞藍色的是細胞核
3D模型需要較少細胞,更具成本效益,且能用於高通量檢測。
