肝细胞
肝细胞是肝脏的主要功能细胞,负责大多数药物的选择性吸收丶代谢及排出。
人原代肝细胞
人原代肝细胞是获取临床前数据的最佳模型,通常药厂用於按FDA要求的药物安全评估及DMPK分析。
在传统平台 ( 二维夹心培养),原代肝细胞会随时间流逝而失去活性及功能。应求的三维细胞三重培养模型显示星状细胞及Kupffer细胞能促进长久维持肝细胞功能,从而能更好地预测在人体内的结果。
相比传统二维培养,三维肝细胞培养的优势:
- 高通量及更符合成本效益(三维培养需要的原代肝细胞数量比二维培养少5倍)
- 能长久保持肝细胞功能
- 通过与其它肝细胞共培养促进肝CYP酶表达
- 药物反应更贴近临床结果

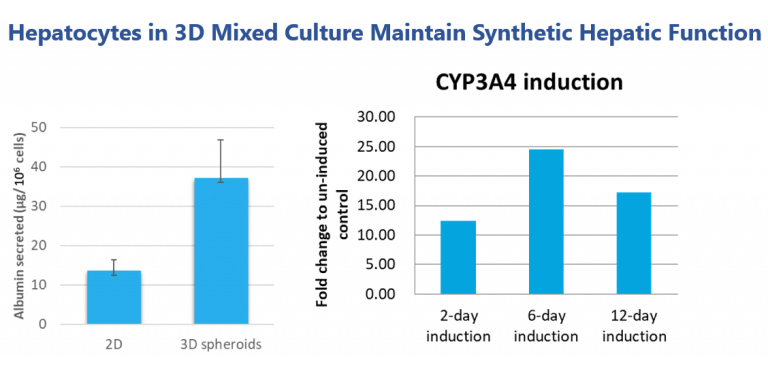
於我们的三维球体培养中,肝细胞显示出更佳的表达功能,比如白蛋白分泌。三维肝细胞球状体可维持肝细胞色素P450酶功能,可用作药物诱导研究。
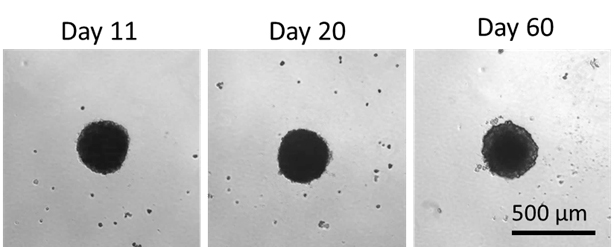
细胞活性可维持60日,显示此为一个优质模型用作长期药物毒性研究。
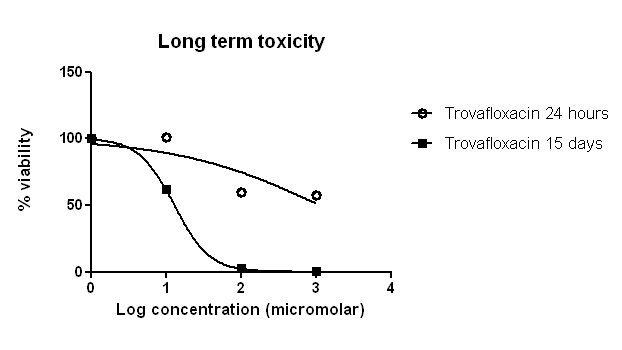
Trovafloxacin因有导致肝中毒的风险已被禁止於巿场中出售,最初它的毒性不能从传统二维培养技术中辩识。但从我们的肝细胞及kupffer细胞共培养模型中,我们可以模拟人类肝脏的微环境及免疫诱导的肝毒性。
HBV病毒感染模型
慢性乙型肝炎在过去一直非常盛行,全球感染人口高达20亿,更是过半数肝癌个案的成因(www.hepb.org)。优质的体外或小动试验模型能改进HBV病毒研究及有助研发对付此恶疾的新药。
在应求,我们使用HepAD38细胞建立了二维HBV病毒感染模型,它是转染了HBV基因组的改良HepG2细胞株。可使用tetracycline通过抑制前基因组(pregenomic)RNA来控制病毒的表达。如果从培养液中移除tetracycline,HBV转录水平的表达及病毒粒子就会显着增加。基於HepAD38细胞株可产生大量旳HBV DNA及病毒表达很容易控制,所以HepAD38已成为一个高通量且价格相宜的新HBV药物测试模型。

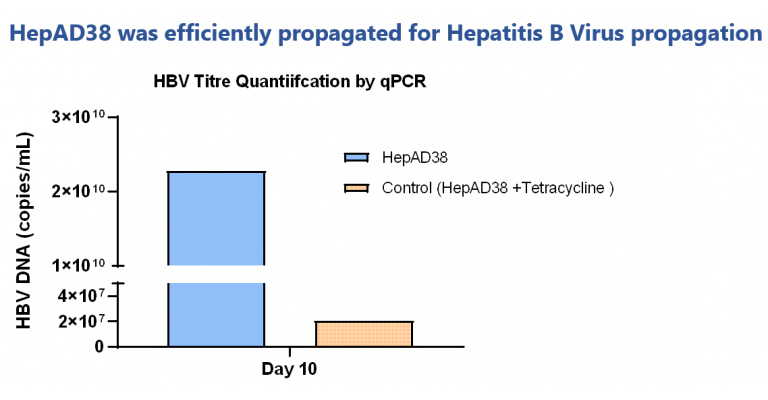
沉积的病毒定量显示良好的滴度水平。Tetracycline对照显示病毒滴度低。
参考: Ladner,Stephanie K.等人。 “在稳定转染的肝母细胞瘤细胞中可诱导表达人类乙型肝炎病毒(HBV):一种筛选潜在的HBV复制抑制剂的新型系统。” 抗菌药物和化学疗法 41.8(1997):1715-1720。
肝细胞及iKCs细胞共培养
Kupffer cells (KC) 细胞占人体内巨噬细胞的80-90%,它是先天肝脏免疫系统的最大细胞群,负责清除和吞噬功能,同时维持肝脏运作正常。
我们的iKCs及肝细胞共培养模型使用从同一iPSC供体来源的细胞,属於供体匹配的共培养模型。对於研究肝脏及其相关疾病如NASH丶肝炎及由免疫药物导致的肝损伤(DILI),是非常有效的体外研究工具。

使用iKCs及肝细胞共培养模型检测免疫诱导的肝损伤(DILI)
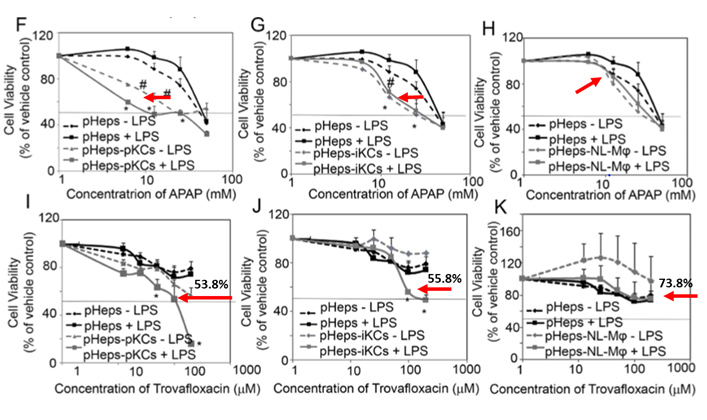
以上研究显示参照药物(acetaminophen (APAP) and Trovafloxacin) 在无免疫细胞的情况下呈现低毒性。当免疫细胞存在时,它们的肝毒性显着增加(模拟临床反应) ,此乃传统模型无法预测的。
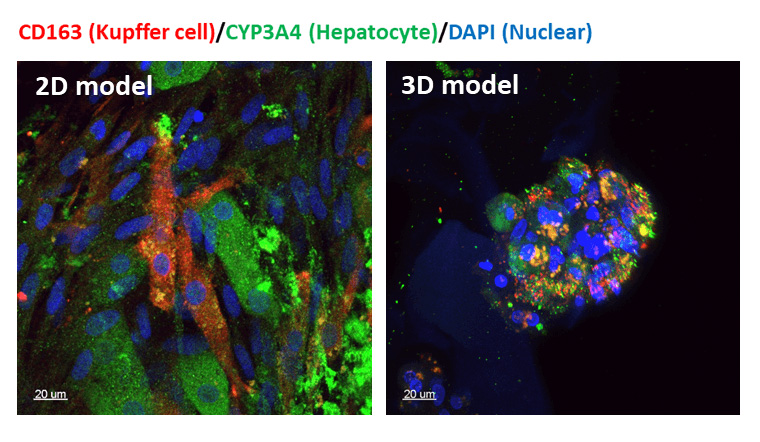
肝-Kupper细胞共培养的共聚焦图像红色的是Kupper细胞绿色的是肝细胞蓝色的是细胞核
三维模型需要较少细胞,更具成本效益,且能用於高通量检测。
